Atualmente, várias técnicas laboratoriais avançadas são usadas para avaliar a resposta imune celular nos suínos, quer seja pela utilização de células imunes do sangue (células mononucleares do sangue periférico, PBMC) quer seja através das células imunes derivadas de órgãos periféricos como o timo, os gânglios linfáticos, o baço, o intestino, o pulmão e a medula óssea. Estas técnicas foram bastante aperfeiçoadas em medicina veterinária e atualmente podem ser usadas em investigações experimentais ou de campo. A citometria de fluxo também é usada em oncologia de pequenos animais.
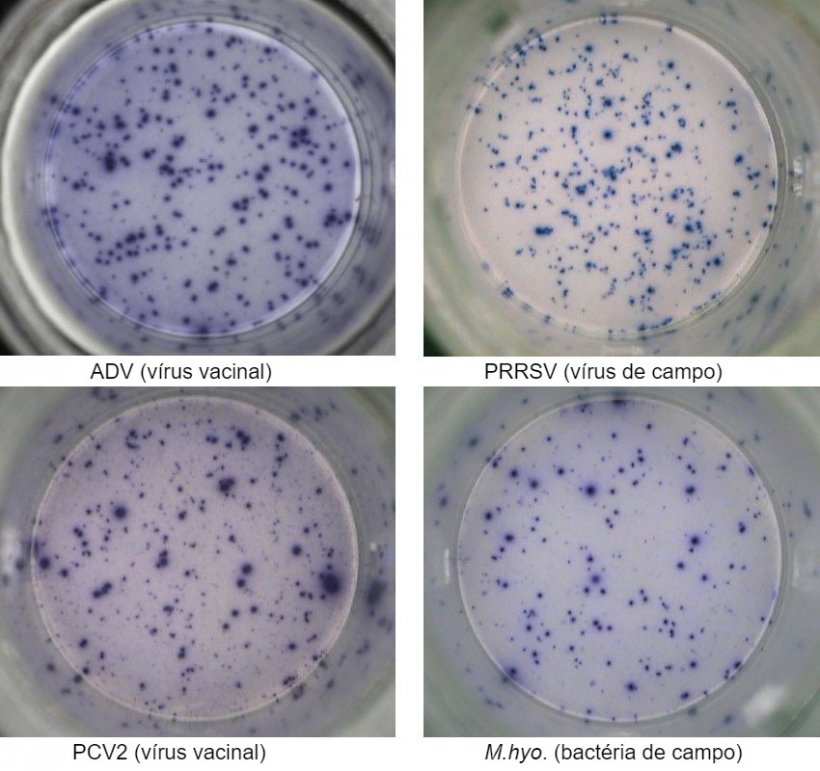
Uma das técnicas mais utilizadas é o ensaio ELISPOT de IFN-y através do qual se pode quantificar o número de células secretoras de IFN-y com elevada sensibilidade após estimulação celular com um antígeno viral (por exemplo, PRRSV, PCV2, ADV) ou antígenos micoplasmais/bacterianos (ex. Mycoplasma hyopneumoniae, Escherichia coli).

São isoladas as PBMC do sangue completo de animais que entraram em contato com o agente patogênico devido à vacinação prévia e/ou infecção natural e são quantificados os linfócitos T que são reativados com um antígeno do mesmo agente patogênico ou pelo próprio agente patogênico
Este ensaio pode fornecer informações relevantes sobre o estado efetivo de ativação do sistema imune do animal. De fato, a indução específica através de vírus ou bactérias de células T de memória e efetoras é detectada pela secreção de IFN-y ao nível da célula única, visualizando em placas de 96 loci.
Utilizando o ensaio ELISPOT, pode monitorizar-se a reatividade imunológica ao longo do tempo comparando formas de vacinação clássicas ou inovadoras (por exemplo, administração intramuscular vs. vacinação intradérmica sem agulha), também se podem comparar programas vacinais ou realizar infecções com agentes patogênicos emergentes para avaliar a resposta dos animais infectados e a eficácia de novas vacinas em termos de proteção e proteção cruzada.
A resposta imune celular é avaliada mediante a contagem de pontos produzidos devido a secreção de IFN-γ por cada célula individual e geralmente é expressa em número de células secretoras de IFN-γ por milhão de células testadas. Se a amostra for positiva, significa que o animal foi exposto ao antígeno viral ou bacteriano no campo e que, portanto, desenvolveu imunidade com células T de memória que pode dar um grau de proteção a uma exposição subsequente ao mesmo agente patogênico e/ou proteção cruzada contra variantes do agente patogênico.
Citometria de fluxo é uma técnica sensível e específica que permite identificar (imunofenotipagem) e quantificar sub-populações de células imunes no sangue periférico (PBMC) ou células isoladas de tecidos/órgãos imunitários que são coradas utilizando anticorpos conjugados com fluorocromo que reagem com os principais marcadores imunitários intracelulares ou de superfície.
Por conseguinte, podem observar-se alterações nesses sub-grupos durante tratamentos experimentais específicos ou em tratamentos de campo, tais como vacinas ou administração de imunoestimulantes ou outros fármacos, bem como em infecções experimentais e naturais. Normalmente, os marcadores mais utilizados para citometria de fluxo são as moléculas de CD (cluster de diferenciação) expressas na superfície das células imunes, através das quais vários sub-conjuntos de monócitos (por exemplo CD172, CD14, CD16, CD163) e linfócitos (CD3, CD4, CD8, CD27, CD1, CD2, CD16, CD14, CD25, CD79) podem ser identificados.
O estado de ativação destas células pode ser determinado através de tinção intracelular de moléculas relacionadas com a ativação e secreção de moleculas como as citoquinas pró-inflamatórias (por exemplo, IL-1, TNF-α, IL-6) e as imunocitocinas (por exemplo, IL-2, IFN-γ, IL-10) e os fatores de expressão (por exemplo, FoxP3).
Deste modo, após uma infecção e usando diversos tipos de tinção, podem identificar-se e estudar-se sub-grupos imunológicos polifuncionais capazes de produzir múltiplas citocinas simultaneamente. Estas parecem ser as células relevantes capazes de regular e fornecer depuração e proteção contra agentes patogênicos.
![Fig. 2. Exemplos de fenótipos de células imunes de citometria de fluxo de células imunitárias quantificadas como percentagem ou valores absolutos [número de células/ml de sangue]) em PBMC de suíno: ac) Sub-populações de linfócitos T: CD3 + CD4 + CD8- = linfócitos T auxiliares (Th) CD3 + CD4 + CD8 + = células T de memória CD3 + CD4-CD8 + = linfócitos T citotóxicos (CTL) de) sub-populações de monócitos pró-inflamatórios: CD172 + CD14 + CD16 + CD172 + CD16 + CD163 + CD172 + CD14 + CD163 + fg) CD4 + CD25 + FoxP3 + = linfócitos T regulatórios (Tregs) ..](https://www.3tres3.com.br/3tres3_common/art/br/1293/citometria-de-fluco_178181.jpg?w=820&q=1&t=1653979446)
Linfoproliferação mediante estimulação in vitro com ativadores policlonais mitogênicos (inespecíficos) e monoclonais (por exemplo, específicos para vírus e bactérias) pode ser uma maneira fácil de avaliar a reatividade das células T imunitárias quando o animal é submetido a tratamentos que podem alterar a resposta a mitógenos ou antígenos patogênicos que ativem a proliferação e induzam uma mudança de células quiescentes para células proliferantes ativadas (ou seja, linfoblastos).
A linfoproliferação pode ser avaliada através de um ensaio de MTT (incorporação e mudança de cor de um reagente por células em proliferação) mas também por citometria de fluxo através da quantificação dos linfoblastos (células de tamanho grande) e/ou incorporação de reagentes fluorescentes de proliferação após estimulação in vitro durante 2-5 dias.
Tecnologia Tetrâmetros tem sido usada em suínos para quantificação por citometria de fluxo de linfócitos T citolíticos/citotóxicos de memória antígeno-específicos e, mais recentemente, para quantificação de células B de memória antígeno-específicas.

Baseia-se no uso de macromoléculas fluorescentes carregadas com um antígeno que são expostas a uma população de células imunes mistas para interagir com as células B e T que reconhecem seletivamente o antígeno e, presumivelmente, são responsáveis pela eficácia da resposta e depuração celular/redução da quantidade de agentes patogênicos no corpo do animal. Este é um método altamente específico e sensível que é capaz de detectar pequenas frações de células B e T de memória. Por exemplo, foi desenvolvido para reconhecimento de linfócitos T citotóxicos CD8+ específicos para vírus da Influenza Suína (SIV), específicos para vírus da Febre Aftosa (FMDV) e linfócitos B de memória específicos para PRRSV.
O ensaio de citotoxicidade utilizam linfócitos T efetores citolíticos/citotóxicos (E) isolados previamente e depois incubados durante 3-4 dias em placas de 96 loci com células-alvo (T) em diferentes proporções (E/T); a eficácia da citólise fornece informações sobre o potencial imunitário das células T efetoras contra células-alvo in vivo potencialmente infectadas.



