Os anticorpos (Ac) ou imunoglobulinas (Ig) são:
- Produzidos por linfócitos B estimulados por antígenos e diferenciados em células plasmáticas (células secretoras de anticorpos, em inglês ASC: Antibody Secreting Cells)
- Secretados em fluídos corporais extracelulares.
- Capazes de se unir e atacar a agentes patogênicos estranhos, neutralizando-os e eliminando-os através de múltiplos mecanismos.
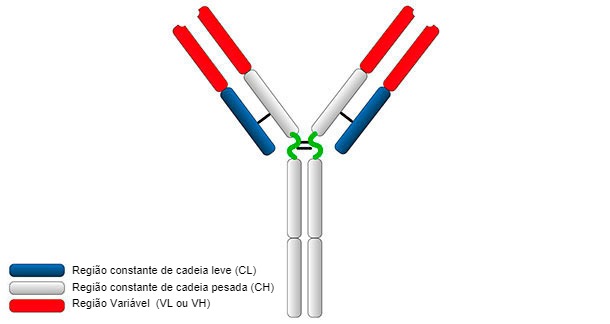
O monômero de imunoglobulina tem um peso molecular de 150-180 kDa e tem uma forma parecida com Y (Figura 1).

Figura 1. Estrutura geral de uma imunoglobulina.
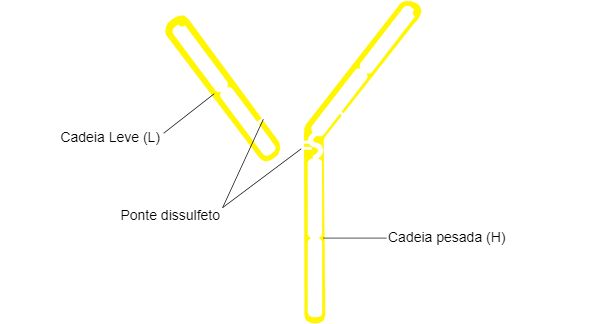
A estrutura típica de Ig consiste em duas cadeias pesadas (H: heavy) e duas ligeiras (L: light) unidas por pontes dissulfureto. Ambas as cadeias constam de duas partes, uma região constante (C) e uma região variável (V).
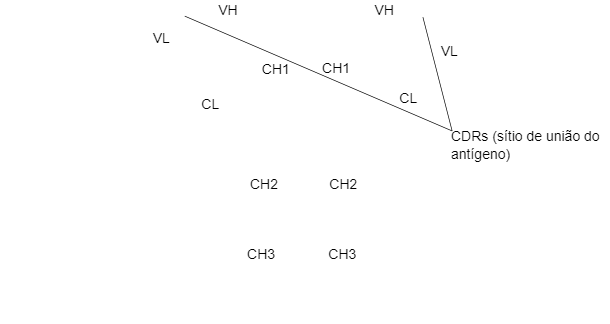
As cadeias H e L têm regiões ou domínios onde a proteína se une para formar uma área globular, denominada VH, CH e VL, CL, respectivamente. As cadeias pesadas são formadas por uma parte variável (VH) e três (para IgG e IgA) ou quatro (para IgM e IgE) domínios constantes denominados CH1, CH2, CH3 e CH4. A cadeia ligeira pode ser do tipo λ ou κ e é formada por dois domínios, um variável (VL ou VK) e outro constante (CL ou CK). Os domínios VH e VL têm regiões altamente variáveis denominadas CDRs (regiões determinantes da complementariedade) que são o sítio de união para um antígeno específico.
Há uma união entre CH1 e CH2 que permite a flexibilidade das moléculas de Ig. A digestão desta região de união com proteases resulta em dois fragmentos Fab que contêm o sítio de união do antígeno e um Fc (fragmento cristalizável) implicado nas funções do anticorpo.
Os domínios CH2 e CH3 são os sítios de união para os receptores Fc, enquanto que os domínios CH1-CL se unem ao fragmento complementar C4b e o domínio CH2 se une ao fator C1q do complemento.
Uma bactéria possui diferentes epítopos superficiais, durante uma infecção produzem-se diferentes anticorpos e cada anticorpo se unirá ao seus epítopos específicos sobre o agente patogênico.
As diferentes sequências de aminoácidos da região constante da cadeia pesada caracterizam as diferentes classes de anticorpos ou isótipos (Figura 2): IgD (cadeia pesada δ), IgM (cadeia pesada μ), IgG (cadeia pesada γ), IgA (cadeia pesada α) e IgE (cadeia pesada ε). As IgM são segregadas como pentâmeros e as IgA como dímeros secretores.

Já foram descritas algumas sub-classes de Ig com diferentes cadeias pesadas, principalmente entre os IgG e IgA.
Os diferentes anticorpos são os efetores da imunidade humoral contra agentes infecciosos e, portanto, estão presentes em altas concentrações no soro e em outros fluídos biológicos (secreções mucosas (por exemplo saliva), leite, colostro, etc.). O papel defensivo dos anticorpos deve-se a diferentes mecanismos (descritos na segunda parte do artigo).
As IgG são imunoglobulinas com um peso molecular de aproximadamente 108 kDa. As imunoglobulinas IgG estão em maior em maior quantidade no soro e nos espaços extravasculares. As IgG estão principalmente envolvidas na resposta defensiva sistêmica. São eficazes na neutralização de vírus, na interação com a fração C1 do complemento e na ativação da cascata do complemento com opsonização e fagocitose de agentes patogênicos. Além disso, promovem a morte de células infectadas mediante citotoxicidade celular mediada por anticorpos (reações ADCC -Antibody Dependent Cell-Mediated Cytotoxicity). O suíno tem seis subclasses de IgG, de IgG1 a IgG6.

Os monômeros de IgM com um peso molecular de aproximadamente 108 kDa estão unidos à superfície das células B e têm um papel como BCR (Receptor de Células B) para o reconhecimento de antígenos. As IgM secretadas apresentam uma forma de pentâmero com uma forma circular na qual se juntam cinco sub-unidades de monômero unidas por ligações dissulfeto e uma cadeia J, esta forma pentamérica tem aproximadamente 900 kDa de peso molecular.
A IgM é a primeira imunoglobulina sintetizada quando há um primeiro contato com o antígeno. É secretada, principalmente, como parte da resposta imunitária humoral primária para uma primeira e importante defesa contra infecções virais e bacterianas. A presença de IgM específica contra um agente patogênico no soro indica infecção recente/aguda. Também são secretadas, durante a resposta secundária, mas numa quantidade menor. Nesta forma, as regiões Fc estão no centro com dez sítios de união ao antígeno na periferia. As IgM são capazes de se unir a mais moléculas do fragmento C1 para a via clássica e são altamente eficientes na ativação do complemento para a opsonização, assim como na neutralização e aglutinação do vírus.
Os chamados anticorpos IgM naturais (NA: "Anticorpos Naturais" - IgM) são produzidos por alguns subconjuntos de linfócitos B que podem estar envolvidos como defesa de primeira linha contra a propagação sistêmica de agentes infecciosos.
A IgA é a classe predominante de Ig nas secreções (saliva, muco, lágrimas, colostro, leite) nas superfícies mucosas e previne a penetração e colonização de agentes patogênicos.
As IgE são imunoglobulinas de aproximadamente 190 kDa de peso molecular e estão presentes em baixa concentração no sangue. As imunoglobulinas IgE estão especificamente implicadas na hipersensibilidade tipo I e na defesa contra os parasitas.
O monômero IgD tem um papel principal como BCR.