A integridade do epitélio e a secreção mucosa representam a primeira barreira física de defesa contra antígenos, toxinas e microrganismos. Além disso, as células epiteliais e de imunidade inata segregam proteínas antimicrobianas (AMPs) em resposta a agentes patogênicos.
A defesa mais importante contra agentes patogênicos primários ou oportunistas está representada por células de imunidade inata e adquirida associadas à superfície mucosa, organizadas em estruturas bem definidas chamadas tecidos linfoides associados a mucosas (MALT), ex. tecido linfoide associado a intestino (GALT), PP (placas de Peyer), BALT (tecido linfoide associado a brônquios), NALT (tecido linfoide associado a nasofaringe), etc., ou disseminadas no epitélio e na lâmina própria.

A expressão de PRRs, principalmente de TLRs e receptores tipo NOD (NLRs), em células epiteliais e de imunidade inata modula o reconhecimento e a resposta inflamatória/imune contra microrganismos.
A imunidade da mucosa intestinal desenvolve-se desde o nascimento, associada à colonização da microbiota que impulsiona a maturação imune e a expansão de estruturas GALT, o que influi no aparecimento de subpopulações efetoras de linfócitos e células B implicadas na produção de IgA. Diferentes subpopulações de CD4, CD8, linfócitos γδT e células de imunidade inata localizam-se na lâmina própria e no epitélio (figura 1).
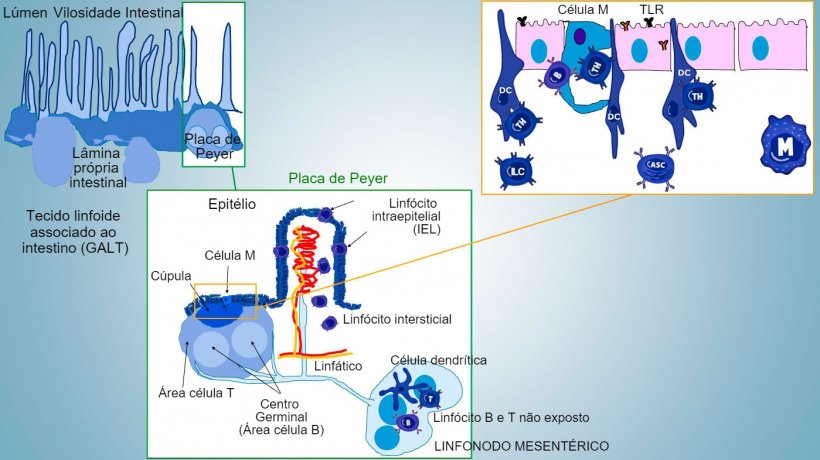
Os subconjuntos mais importantes de Thelper que se diferenciam na lâmina própria intestinal são os linfócitos T reguladores (Treg), Th1, Th2 e Th17. As células linfóides inatas (ILCs) também desempenham um papel chave na resposta imune de superfícies barreira, interagindo com outras células de imunidade inata e adquirida, principalmente com Th17.
Além disso, a microbiota intestinal inibe a colonização e o crescimento de agentes patogênicos, ao proporcionar sinais que sustentam algum mecanismo inato, por exemplo, a secreção de proteínas antimicrobianas.
Nos pulmões, os linfócitos Th1 citotóxicos CD4 e CD8 estão presentes como células efetoras contra o agente patogênico intracelular, mas também estão implicados outros subconjuntos que incluem Th2, Th17, Treg e TFh.
A imunidade da mucosa é capaz de discriminar entre microrganismos comensais, antígênos de alimentos ou aerossóis e agentes patogênicos primários.
Os antígenos de aerossóis e alimentos, assim como a microbiota comensal, geralmente, não estimulam uma resposta inflamatória/imune, eles induzem uma tolerância imune (figura 2).
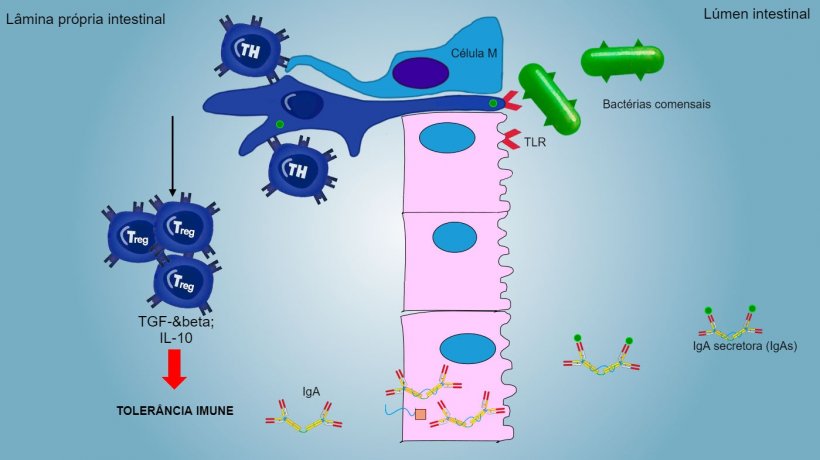
Funcionalmente, a resposta imune na superfície mucosa diferencia-se em sítios indutivos e efetores:
- Sítios indutivos: PP, folículos linfoides isolados (ILF), NALT, BALT, linfonodos mesentéricos (MLN). Seleciona os antígenos e ativam a resposta imune.
- Sítios efetores: lâmina própria da mucosa intestinal, trato respiratório superior, trato geniturinário, glândula mamária e salivar. Gera uma resposta defensiva que induz a resposta imune inflamatória/inata e específica.
Nos sítios indutivos, os antígenos são capturados pelas células M (com microvilos) que os transportam internamente e os liberam no espaço extracelular, onde são capturados e processados pelas células dendríticas subjacentes. As DC da lâmina própria também podem capturar diretamente o antígeno com as suas proeminências citoplasmáticas, que se estendem entre os enterócitos.
Nas PP, a apresentação de antígeno a Thelper faz com que as células B comutem de classe para a produção e secreção de IgA na lâmina própria e lúmen intestinal, como mecanismo efetor defensivo (figura 3). De maneira alternativa, as DCs intestinais carregadas de antígêno migram para o linfonodo mesentérico induzindo uma posterior ativação de células B e T antígeno-específicas, logo, a migração de linfócitos B ativados assegura a produção local de IgA e também uma resposta na superfície mucosa à distância (figura 4).
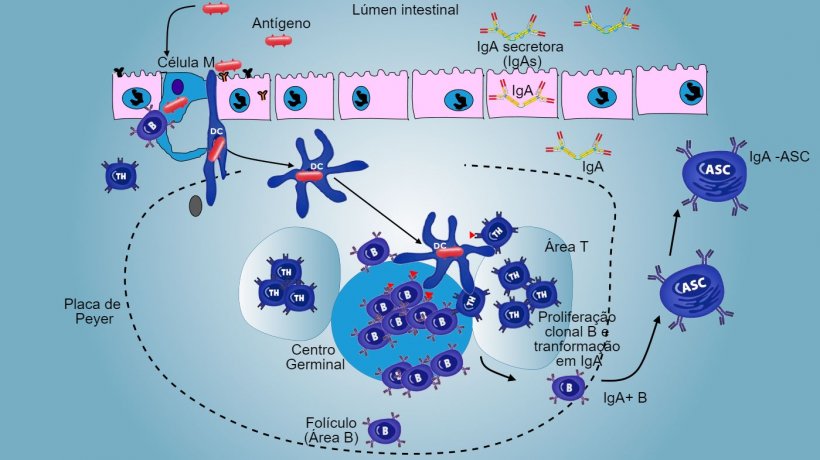

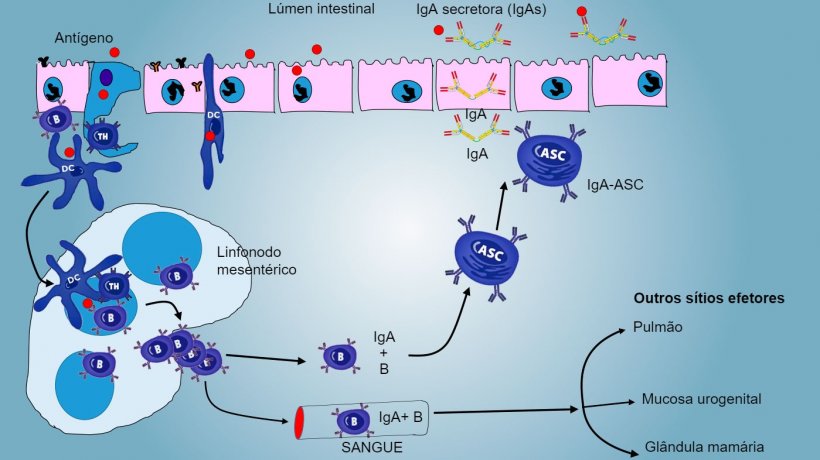
De forma semelhante, foi demonstrada a capacidade de imunização nasal para conferir uma resposta imune, tanto local como distal, através do tráfico de células longe do tecido linfoide associado aos brônquios.
Nos sítios efetores, a resposta imune varia segundo o agente patogênico a ser enfrentado (figura 5).
No caso de infecção de agente patogênico intracelular, produz-se uma resposta inflamatória mediada por TLR e NOD com uma ativação posterior da resposta imune mediada por Th1 e a ativação de células NK e linfócitos T citotóxicos capazes de matar e destruir células infectadas. Esta resposta poderá estar associada com uma ativação B eficaz e uma secreção de anticorpos de superfície.
Os linfócitos intraepiteliais γδT estão implicados na eliminação inicial de células infectadas ou na secreção de AMP, assim como na homeostase intestinal.
Uma resposta mediada por Th17 exerce um papel crítico na proteção dos sítios da mucosa principalmente contra bactérias extracelulares e fungos, mas também contra vírus, na lâmina própria do intestino, onde estes linfócitos estão presentes de maneira abundante. Durante uma resposta inflamatória, os linfócitos Th17 ativados por IL-23, segregam IL-17 e IL-22, citocinas que impulsionam a produção de peptídeos antibacterianos e o recrutamento e ativação de granulócitos neutrófilos inflamatórios (figura 5).
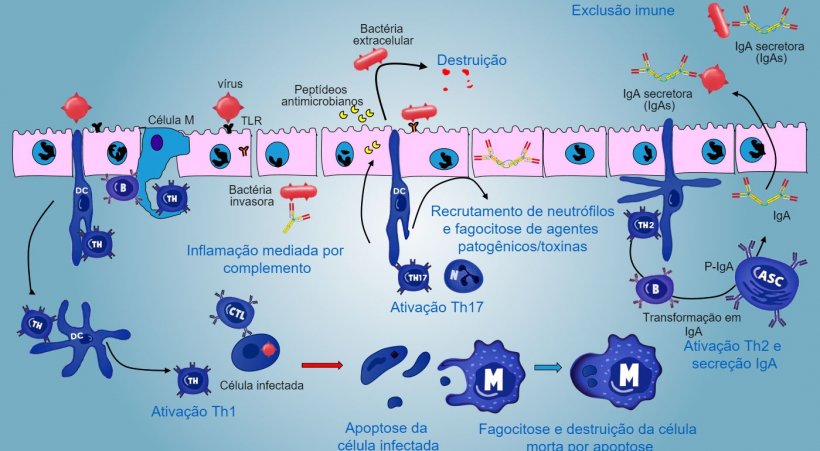
Nos pulmões, a proteção contra agentes patogênicos implica na produção de citocinas inflamatórias (TNFa, IL-1β, MIP-1α e MIP-1β) e o recrutamento de neutrófilos, macrófagos e linfócitos como células T CD4, células T CD8 e linfócitos Tγδ.
A produção e secreção de IgA secretora de anticorpos é um mecanismo efetor principal da imunidade da mucosa (figura 6).
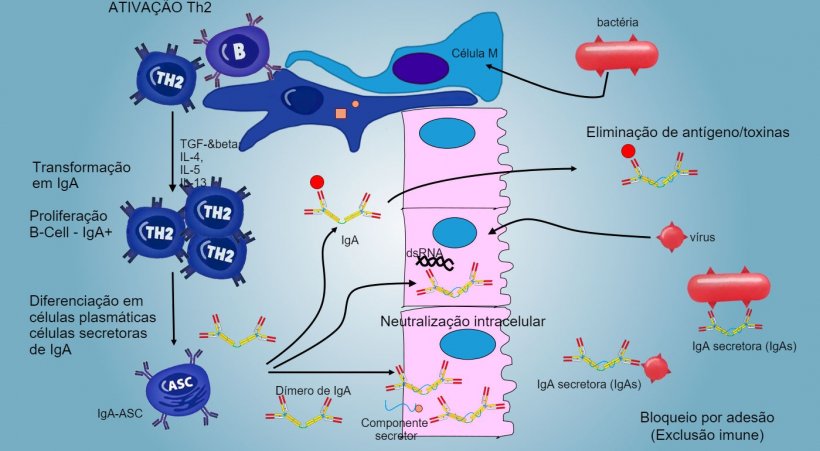
A IgA predomina em todas as superfícies e secreções mucosas, as células plasmáticas presentes no tecido linfoide ou na lâmina da mucosa realizam uma secreção constante de IgA.
Nas PP intestinais, a ativação de linfócitos B gera células plasmáticas secretoras de IgA. As IgA segregam-se principalmente como dímeros de IgA onde dois monômeros se juntam através de uma cadeia J e unem-se a um componente secretor que protege s-IgA da ação de enzimas proteolíticas intestinais. As IgA evitam a aderência de vírus e bactérias a células epiteliais (mecanismo de imunoexclusão), são capazes de se unir a proteínas virais dentro da célula e bloquear a replicação (neutralização intracelular) assim como unir-se a antígenos penetrados na mucosa e transportá-los através do epitélio para os eliminar no lúmen (eliminação de antígenos).
A "mudança" em IgA regula-se principalmente através da ativação de linfócitos Th2 com produção de citocinas TGF-β, IL-4, IL-5, IL-13. O dímero de IgA segregado une-se a um receptor (pIgR) na superfície basal das células epiteliais. O complexo vai para dentro da célula e, antes de migrar através da superfície luminar, o receptor divide-se e a IgA permanece unida ao resíduo do receptor (componente secretor).
A nível respiratório, a IgA predomina nas zonas superiores (cavidades nasais, faringe, laringe, traqueia, brônquios), enquanto que nas zonas inferiores (bronquial e alveolar) existe principalmente uma resposta imune sistêmica com participação dos linfonodos envolvidos e secreção predominante de IgG.



