Os sistemas inatos de reconhecimento celular baseiam-se em proteínas superficiais ou intracelulares de células epiteliais, neutrófilos, macrófagos e células dendríticas e em receptores citoplasmáticos solúveis. Todos estes receptores são, geralmente, chamados PRRs (Receptores de Reconhecimento de Padrões) e ligam-se a moléculas PAMPs (Padrões Moleculares Associados a Agentes Patogênicos) expressas somente pelo agente patogênico (lipopolissacarídeos, hidratos de carbono e lipoproteínas bacterianas, peptideoglicanos, ARN, ADN, etc.) bem como microbiota comensal.

Reconhecimento de agentes patogênicos pelo sistema imune inato ou natural
TLR (receptores tipo Toll). Foram identificados dez membros diferentes no suíno. São capazes de reconhecer os produtos bacterianos fora das células e o ácido nucleico viral dentro da célula. Assim, alguns TLR localizam-se em compartimentos intracelulares para reconhecer o ácido nucleico viral ou bacteriano. Outros TLRs estão na superfície celular e reconhecem produtos bacterianos (lipoproteínas, peptideoglicanos, lipopolissacarídeos).
RLRs Receptores parecidos a RIG-I (Gene indutível pelo ácido retinóico I). São receptores citoplasmáticos que reconhecem dsRNA viral.
Proteínas NOD (Domínio de oligomerização por união de nucleotídeos) São PRRs citosólicos que cooperam com TLRs no reconhecimento de produtos bacterianos.
CLR (Receptores de lectina de tipo C) são uma família de receptores de superficie que incluem a colectinas, as pentraxinas, as selectinas, os receptores de dectinas e as manoses.
As proteínas pertencentes ao sistema do complemento e as proteínas de fase aguda são capazes de actuar como um receptor solúvel de reconhecimento: fragmento C3, proteína de união à manose (MBP), surfactantes, proteína C reactiva (CRP).
A ativação mútua de células em diferentes níveis tissulares, células epiteliais e endoteliais e, especialmente, células inflamatórias e inatas, é a primeira barreira física e funcional contra agentes patogênicos desencadeando a resposta inflamatória.
Tabela 1: Sistemas de reconhecimento inato ou natural do agente patogênico.
| RECEPTORES | ATIVIDADE DE RECONHECIMENTO | ||
| Grupo de TLR (membrana ou intracelular) | Reconhecimento de produtos bacterianos e de fungos | TLR1 | Lipopeptídeos (bactérias e micoplasmas) |
| TLR2 | Lipoproteínas e proteoglicanos (gram+) Lipopeptídeos (micoplasmas) LPS (Leptospira) Lipo arabino manano (micobactéria) Lipopeptídeos (micoplasmas) (gram+) Zimosano (fungos) |
||
| TLR4 | LPS (gram-) Proteína F de RSV HSP60 (Chlamydia) |
||
| TLR5 | Flagelina (muitas bactérias) | ||
| TLR6 | Regula o TLR2 Lipopeptídeos (micoplasmas) Lipopeptídeos (micoplasmas) (gram-) Zimosano (fungos) |
||
| TLR9 | CpG DNA bacteriano | ||
| TLR10 | Desconhecido | ||
| Reconhecimento de produtos de vírus | TLR3 | dsRNA | |
| TLR7 TLR8 |
ssRNA. Restringe-se a pDCs e não se expressa nos cDCs | ||
| TLR9 | CpG DNA de vírus. Restringe-se a pDCs e não se expressa nos cDCs | ||
| Família CLRs (membrana) |
Selectinas, dectina 1,2 |
Reconhece o domínio de hidratos de carbono do agente patogênico e induz a fagocitose ou a ativação do inflamossoma, com a produção de citocinas pró-inflamatórias, em particular, dirigindo a resposta imune para a finalização Th1 ou Th17. | |
| RLRs (intracelular) |
RIG-1 |
Vincula o ARNsc durante a replicação de ARN do vírus, induzindo a produção de citocinas pró-inflamatórias e IFN tipo I e confere um estado antiviral às células infectadas. | |
| Proteínas NOD (citoplasmático-intracelular) | NOD1 NOD2 |
Interação com componentes microbianos (porções de proteoglicanos) através da sua região específica. Os NOD suínos expressam-se intensamente nos gânglios linfáticos mesentéricos e nos tecidos linfoides associados ao intestino (GALT), mantendo o seu papel na resposta imunitária inata contra as infecções bacterianas. | |
| APPs (Proteínas de fase aguda) (solúvel) |
Proteína C-Reactiva (CRP) | Produzido no fígado, une-se aos resíduos de fosfatidilcolina presentes na parede de algumas bactérias e fungos, ativando o sistema do complemento de maneira clássica e aumentando a fagocitose por macrófagos (fagocitose mediada por opsonina). | |
| Lectina de união à manose (MBL) | É uma colectina do grupo de lectinas capaz de unir açúcares que contêm manose, reconhecendo assim um grande número de vírus, bactérias, fungos e protozoários. MBL é capaz de ativar o sistema complemento de uma forma clássica ou C1-independente que promove a fagocitose mediada por opsoninas. |
Sistemas específicos de reconhecimento de agentes patogênicos

As células imunitárias específicas B e T têm receptores que reconhecem determinantes específicos de antígenos (epítopos) do agente patogênico.
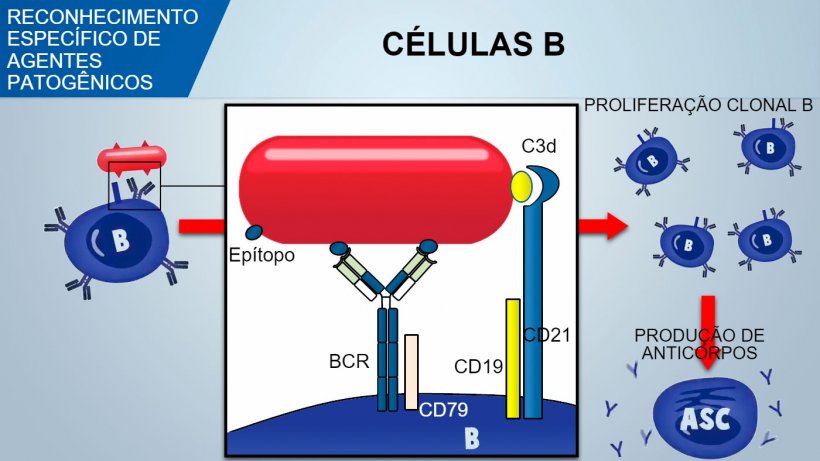
Os linfócitos B Naïve têm múltiplos receptores de superfície chamados BCR (receptor de células B) constituídos por uma imunoglobulina de superfície, IgM ou IgD, específica para um único antígeno. Durante o desenvolvimento das células B na medula óssea cria-se, por recombinação genética, um enorme reportório de BCRs e, por conseguinte, de células B, para reconhecer um enorme número de antígenos específicos sobre os agentes patogênicos.
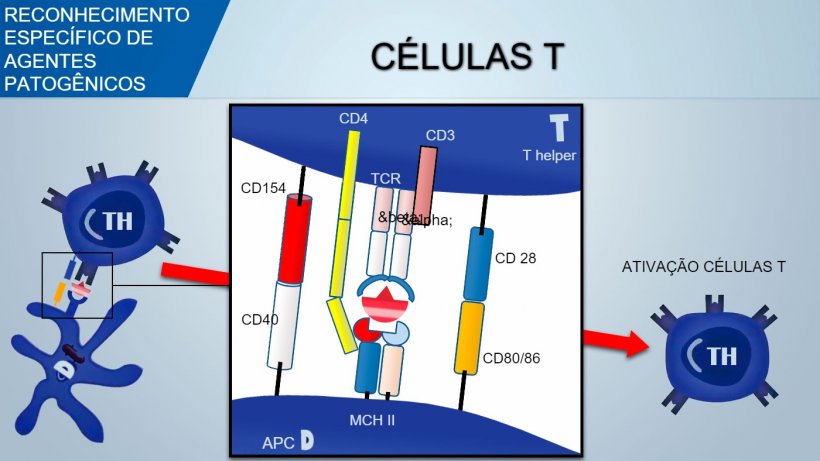
O receptor de células T (TCR) de linfócitos T auxiliares (T helper) e linfócitos T citotóxicos é constituído por duas cadeias α e β. O TCR dos linfócitos T e δ é constituído por duas cadeias γ e δ. Com um mecanismo similar produz-se a variabilidade do reconhecimento antigênico de TCR nos linfócitos T.
As células B reconhecem os determinantes antigênicos nativos do agente patogênico e o sinal transduz-se dentro da célula mediante a ativação de uma glicoproteína associada (CD79α/β). Uma vez internalizado o complexo antígeno-BCR, as células B processam o antígeno e apresentam-no em associação com o MHC II aos linfócitos T auxiliares. A coestimulação entre células B e T é essencial para a ativação das células B e para desencadear uma formação eficiente de anticorpos. Uma coestimulação eficaz também requer um sinal mediado por um complexo CD21/CD19 que reconhece o fragmento do complemento (C3d) no agente patogênico.
Pelo contrário, as células T reconhecem determinantes de antígenos processados e apresentados por APC em associação com o MHC (Complexo Maior de Histocompatibilidade).
O MHC II são moléculas presentes principalmente na superfície de APC profissionais, tais como células dendríticas maduras, macrófagos inflamatórios ativados e células B ativadas. Por sua vez, o MHC I apresenta antígenos endógenos a linfócitos T citotóxicos.
Nos suínos, os genes de MHC (conhecidos como SLA: "Antigene Leucocitário Suíno") estão no centrômero do cromossoma 7. Os setenta genes (haplótipos) foram definidos pela primeira vez em 1970 e distribuem-se em 3 classes:
- SLA I que codifica as moléculas de MHC I expressas na maioria das células nucleadas exceto as neuronais e os trofoblastos. As moléculas de MHC estão associadas e apresentam antígenos intracitoplásmicos (por exemplo, antígenos virais) a células T CD8 +. As moléculas de MHC I são constituídas por uma cadeia pesada α (altamente polimórfica) e duas β2 ligeiras chamadas β2-microglobulina.
- SLA II: As moléculas do MHC classe II expressam-se em linfócitos B, em APC profissionais, e em algumas subpopulações de linfócitos T independentemente do seu estado de ativação. As moléculas de MHC II estão associadas a antígenos processados (fagocitados e degradados em peptídeos) dentro das APC. As moléculas de MHC II consistem numa cadeia α e uma β.
- SLA III: São genes que codificam para elementos do complemento, citocinas, etc.
Para ativar o linfócito Th, o sinal mediado pelo reconhecimento TCR do complexo antígeno-MHC deveria estar associado ao sinal mediado pela união de moléculas de coestimulação superficial: o CD28 (em células T) une-se ao CD80 (no APC) ou ao CD86 (em células B), e o CD40 (no APC) une-se ao CD154 (em células T). Esta coestimulação aumenta a produção de citocinas para a proliferação de células T (IL-2) e também a diferenciação de Th mediada por citocinas.



