Testes disponíveis:
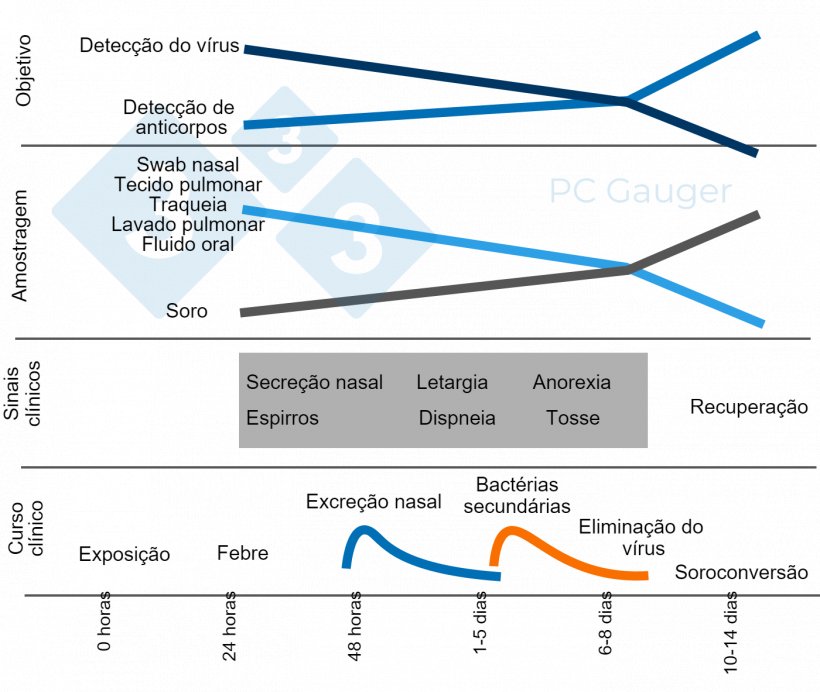
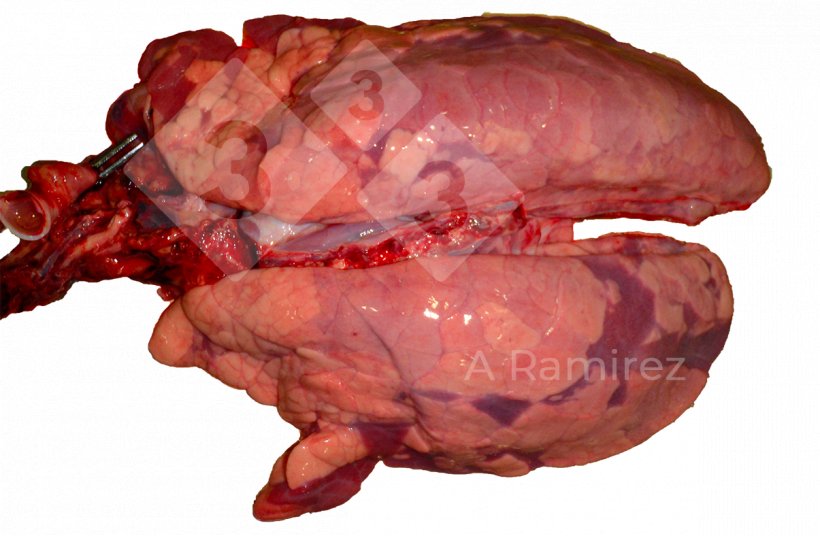
Patologia macroscópica

- Avalia a presença de lesões teciduais que podem sugerir a presença da doença.
- Localização da lesão:
- Consolidação cranioventral (especialmente nos lóbulos apical e cardíaco)
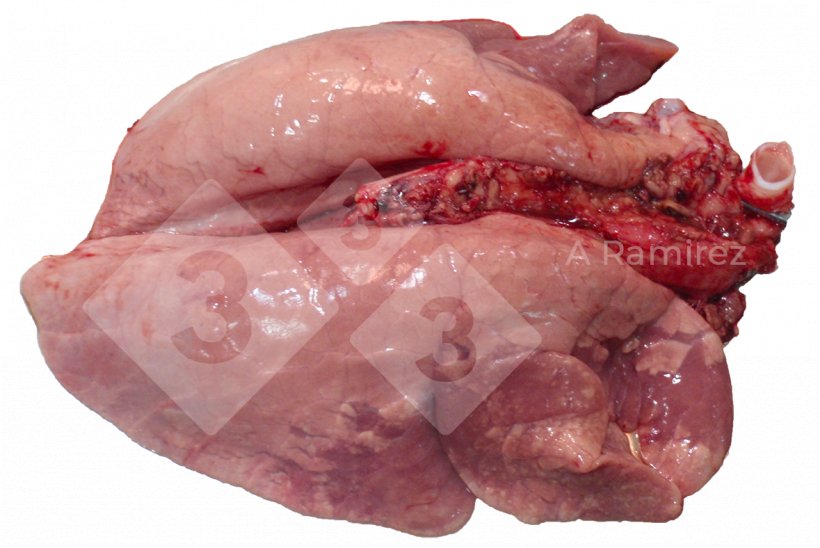
- A apresentação pode ser difusa cobrindo várias áreas do pulmão.
- Pode haver edema interlobular.
- Prós:
- A gravidade das lesões pode estar relacionada à importância clínica.
- Contras:
- Lesões macroscópicas não patognomônicas (muito similares a Mycoplasma hyopneumoniae).
- Muitas vezes há infecções secundárias ou coinfecções.
Histopatologia
- Avaliar a presença de lesões que possam confirmar a presença da doença.
- Tipo de amostra: tecido pulmonar.
- Prós:
- A bronquiolite necrosante é frequentemente considerada patognomônica da infecção pelo vírus influenza A em suínos.

Figura 4: Histopatologia pulmonar mostrando adelgaçamento do epitélio bronquiolar, que é um exemplo de necrose. (Fonte da foto: Phil Gauger ISUVDL). - As lesões características aparecem alguns dias após a disseminação do vírus em suínos, especialmente quando há coinfecções.
- A bronquiolite necrosante é frequentemente considerada patognomônica da infecção pelo vírus influenza A em suínos.
- Contras:
-
Avalia apenas uma pequena quantidade de tecido.
-
Lesões não complicadas podem resolver rapidamente (5-7 dias).
-
Imuno-histoquímica (IHC)
- Detecta a presença do antígeno viral.
- Tipo de amostra: tecido pulmonar.
- Prós:
- Detecta o vírus no local da lesão (boa prova de causalidade).
- O antígeno alvo é geralmente uma nucleoproteína que é conservada em todos os vírus influenza A.
- Contras:
- Avalia apenas uma pequena quantidade de tecido.
- O vírus está presente apenas por um curto período de tempo (alguns dias).
- Requer uma quantidade significativamente maior de vírus do que a PCR.
Isolamento do vírus
- Isola o vírus vivo.
- Tipos de amostras: tecido pulmonar, lavado broncoalveolar, swabs nasais.
- Prós:
-
Critérios de referência.
-
Isolamento do vírus para uso no desenvolvimento de vacinas (vacinas autógenas) ou teste sorológico (inibição da hemaglutinação) para determinar a proteção cruzada.
-
- Contras:
- Caro.
- Resultados demorados.
- Requer ovo de galinha embrionado ou célula de rim canino Madin-Darby (MDCK)
- O processo de inoculação é muito laborioso.
- É difícil cultivar (muitos falsos negativos)
- A manipulação da amostra desde o campo até o laboratório pode afetar a sobrevivência do vírus.
Reação em cadeia de polimerase (PCR)
- Detecta a presença de uma sequência específica de ácido nucleico viral (RNA)
- Tipos de amostras: swabs nasais, fluidos orais, tecido pulmonar, lavado broncoalveolar.
- Prós:
- Os primers (iniciadores) podem ser desenhados para:
- Detecção de todos os subtipos de vírus da influenza A - visando a nucleoproteína conservada.
- Detecção de grupos de vírus de subtipos específicos: subtipo H1, H3, N1 o N2.
- Alta sensibilidade.
- Detecção rápida.
- A quantificação por PCR se associa com a presença de lesões.
- Custo moderado.
-
Amostras de swab ou tecido geralmente podem ser combinadas para reduzir custos e minimizar a perda de sensibilidade (especialmente no que diz respeito à relevância clínica).
-
- Os primers (iniciadores) podem ser desenhados para:
- Contras:
- Alta sensibilidade – especialmente em fluidos orais, pode detectar a presença de pequenas quantidades de vírus na granja, dificultando a interpretação clínica dos resultados com relação à extensão ou gravidade da doença.
- O vírus está presente no hospedeiro apenas por alguns dias (3-5 dias, especialmente em swabs nasais).
- Amostras de sangue ou soro não podem ser utilizadas para o teste de PCR, pois o vírus permanece no pulmão e não é sistêmico.
Sequenciamento genético
- Sequenciar segmentos genéticos do ácido nucléico (RNA) do vírus.
- Tipos de amostras: tecido pulmonar, swabs nasais, lavado broncoalveolar, fluidos orais.
- Prós:
- Permite a diferenciação entre subtipos em muitos níveis diferentes de clados
- H1: é dividido em clados que geralmente são nomeados com o alfabeto grego (alfa, beta, gama, etc.)
- H3: é dividido em grupos que geralmente são nomeados com algarismos romanos (I, IV, etc.)
- Muitos desses clados ou grupos relevantes são descritos aqui.
- Ele pode ajudar a diferenciar a introdução de novos vírus de vírus existentes ou antigos.
- Pode ajudar a selecionar cepas de vacina com base no subtipo/clado.
- Permite a diferenciação entre subtipos em muitos níveis diferentes de clados
- Contras:
- Caro.
- Normalmente apenas o gene HA é sequenciado.
- A variabilidade entre subtipos/clados continua a crescer e está se tornando mais complexa.
Ensaio imunossorvente ligado a enzima (ELISA)

- Detecta a presença do anticorpo.
- Tipo de amostra: soro.
- Prós:
- Os testes ELISA podem ser projetados para:
- Detecção de anticorpos de todos os subtipos - direcionados à nucleoproteína conservada.
- Detecção de anticorpos específicos do subtipo - dirigidos às proteínas específicas hemaglutinina (referida como H ou HA) e/ou neuraminidase (referida como N ou NA)
- Os animais permanecem positivos por várias semanas (começam a declinar após 8-10 semanas).
- Pode ser usado em casos crônicos.
- Os testes ELISA podem ser projetados para:
- Contras:
- Os anticorpos específicos e o tempo de detecção podem variar ligeiramente entre os diferentes kits comerciais disponíveis.
- Animais demoram de 10 a 14 dias para se tornar soropositivos.
- Não distingue entre vacinação e infecção por vírus de campo.
- Não identifica um subtipo específico de vírus.
Inibição da hemaglutinação (HI)
- Detecta a presença de anticorpos.
- Tipo de amostra: soro.
- Prós:
- Os animais permanecem positivos por várias semanas.
- Pode ser usado em casos crônicos.
- Pode ser usado para determinar o momento adequado para a vacinação evitando a interferência de anticorpos maternos.
- Pode ser usado para determinar proteção cruzada entre cepas.
- Contras:
- Cada teste é específico da cepa.
- Requer isolamento da cepa específica para avaliar a proteção cruzada.
- Animais demoram de 10 a 14 dias para se tornar soropositivos.
- Não distingue entre vacinação e infecção por vírus de campo.
Interpretação de resultados:
Patologia macroscópica
- Positivo: Confirmação da presença de pneumonia.
- Negativo: Os casos iniciais podem não manifestar lesões pulmonares extensas.
Histopatologia
- Positivo: Confirmação da doença.
- Negativo: Negativo ou lesões são perdidas se a amostra errada for testada ou testada muito tempo após a infecção.
IHC
- Positivo: O vírus está presente no local da lesão.
- Negativo: Negativo ou o vírus não é detectado se o teste for feito muito tempo após a infecção ou a concentração do vírus for muito baixa (está presente apenas por um curto período de tempo).
Isolamento do vírus
- Positivo: Confirmação da doença.
- Negativo: O vírus não é detectado se testado muito tempo após a infecção ou simplesmente não pode crescer devido a outra contaminação ou manuseio incorreto (presente, mas muito difícil de cultivar).
PCR
- Positivo: Confirmação da doença.
- Negativo: Negativo, o vírus não é detectado se o teste for realizado muito tempo após a infecção ou devido à seleção ou manuseio incorreto da amostra.
- Inconclusiva: Muito pouco vírus presente ou coinfecção com mais de um subtipo.
Sequenciamento genético
- Permite identificar o subtipo e o clado do vírus.
- Permite ajustar a cepa vacinal para melhor proteção.
ELISA
- Positivo: Anticorpos maternos ou exposição prévia (> 2 semanas) à vacina ou vírus de campo.
- Negativo:
- Negativo para vacina ou vírus de campo.
- Infecção muito recente para ser detectada (10-14 dias para soroconversão).
- Incompatibilidade entre teste e vírus (subtipo ou clado).
HI
- Positivo: Anticorpos maternos ou exposição prévia (> 2 semanas) à vacina ou vírus de campo.
- Negativo:
- Negativo para vacina ou vírus de campo.
- Infecção muito recente para ser detectada (10-14 dias para soroconversão).
- Incompatibilidade (subtipo ou clado) entre o vírus utilizado no teste e o vírus que infecta o suíno.
Casos clínicos:
Suínos de terminação com espirros e sinais respiratórios (agudos ou crônicos):
- Coletar 2-4 amostras de fluido oral do grupo e analisar por PCR.
- Coletar 12 amostras de swabs nasais de suínos infetados com sinais clínicos (têm secreção nasal clara), fazer 3 pools de 4 amostras cada e analisar por PCR.
- Sequenciar uma amostra de PCR positiva para determinar melhor o cluster/clado.
Determinação do tempo de exposição e possível necessidade de vacinação:
- Coletar amostras de 10 a 15 suínos. Duas abordagens para a coleta:
-
- Transversal – coleta de diferentes faixas etárias ao mesmo tempo (obtém resultados mais rapidamente).
- Longitudinal – coleta dos mesmos suínos ao longo do tempo (são obtidos resultados mais precisos).
- Análise de amostras de soro por ELISA.
- Coletar 2-4 amostras de fluido oral do grupo e analisar por PCR.
- Sequenciar uma amostra positiva de PCR de cada faixa etária para determinar melhor o cluster/clado.



