Testes disponíveis:
Patologia macroscópica

-
Inspeção visual das lesões pulmonares.
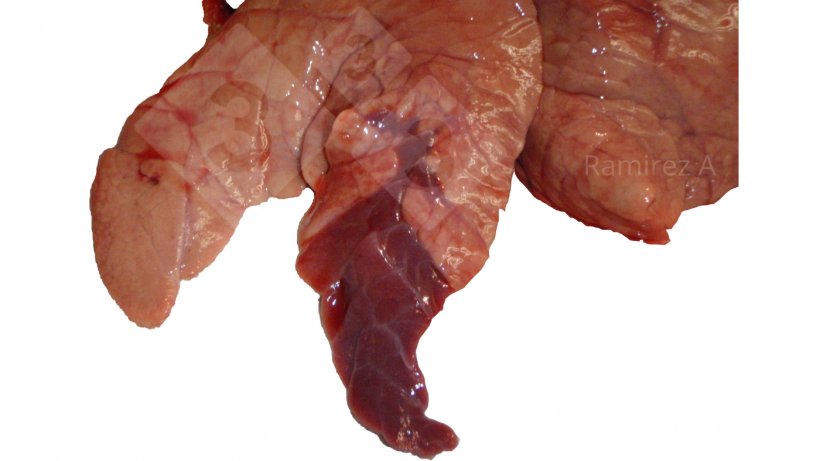
- Prós:
- Fácil de fazer.
- Pode avaliar infecções tardias em suínos enviados para abate.
- Contras:
- Não diagnóstico / patognomônico; muitas outras causas possíveis.
- Requer outra confirmação de diagnóstico.
Cultivo bacteriano
- Isolamento de organismos vivos de tecidos com lesões ou lavagem broncoalveolar.
- Tipos de amostras: lavagem pulmonar ou broncoalveolar.
- Prós:
- Critério de referência.
-
Os suínos podem apresentar resultados positivos por 7 a 8 meses (longo período de colonização).
- Contras:
- Requer um meio de cultura especial (meio Friis).
- Disponível apenas em poucos laboratórios.
- Caro.
- Muito difícil de crescer (muitos falsos negativos).
Imunohistoquímica (IHC)
- Detecta a presença de antígeno bacteriano.
- Tipo de amostra: tecido pulmonar.
- Prós:
- Detecta bactérias no local da lesão (boa prova de causa).
- Os suínos podem apresentar resultados positivos por 7 a 8 meses (longo período de colonização).
- Contras:
- Deve ser enviada a amostra de tecido correta - o tecido pulmonar deve conter um corte transversal das vias aéreas (células epiteliais brônquicas).
- Requer um número significativamente maior de bactérias do que a PCR.
- Avalia apenas uma pequena quantidade de tecido.
Anticorpos fluorescentes (AF)
- Detecta a presença de antígeno bacteriano.
- Tipo de amostra: tecido pulmonar.
- Prós:
- Detecta o vírus no local da lesão (boa prova de causa).
- Os suínos podem apresentar resultados positivos por 7 a 8 meses (longo período de colonização).
- Contras:
- Deve ser enviada a amostra de tecido correta - o tecido pulmonar deve conter um corte transversal das vias aéreas (células epiteliais brônquicas) (Figura 2).
- Requer um número significativamente maior de bactérias do que a PCR.
- Avalia apenas uma pequena quantidade de tecido.
Reação em cadeia da polimerase (PCR)
- Detecta a presença de sequências específicas de ácido nucleico (DNA) bacteriano.
- Tipos de amostras: pulmão, esfregaço (nasal, laríngeo, traqueobrônquico ou brônquico) ou lavado broncoalveolar.
- Prós:
- Sensibilidade muito alta (pode detectar pequenas quantidades de bactérias)
- Várias amostras podem ser agrupadas para aumentar a sensibilidade diagnóstica ao fazer um análise em uma granja.
- Os suínos podem apresentar resultados positivos por 7 a 8 meses (longo período de colonização).
- Custo moderado.
- Contras:
- Não mostra a doença.
- Os fluidos orais são um tipo de amostra ruim (muitos falsos negativos).

Tabela 1: Resumo esquemático da pesquisa e dos resultados de campo sobre a sensibilidade de diferentes tipos de amostra para o teste de PCR de Mycoplasma hyopneumoniae.
| Sensibilidade relativa | Pooling* | |
|---|---|---|
| Fluidos orais | - | Não |
| Hissopo nasal | + | Variável |
| Hissopo laríngeo | ++ | Benéfico |
| Hissopo traqueobronquial | ++ | Benéfico |
| Hissopo bronquial | +++ | Benéfico |
| Lavado broncoalveolar | ++ | Não |
| Tecido pulmonar | ++++ | Sim |
* Polling ou agrupar amostras pode ser benéfico para aumentar a sensibilidade diagnóstica ao realizar um testes em granjas; não de um único animal.
Ensaio Imunoabsorvente Enzimático (ELISA)
- Detecta a presença de anticorpos.
- Tipo de amostra: soro.
- Prós:
- Os animais permanecem positivos por muito tempo.
- Pode ser usado em casos crônicos.
- Contras:
- Os anticorpos específicos e o tempo de detecção podem variar ligeiramente entre os vários kits comerciais disponíveis.
- Não diferencia entre anticorpos maternos e de exposição.
- O nível de anticorpos não se correlaciona com a proteção.
- A vacinação não induz soroconversão (altamente dependente da vacina e do ensaio utilizado).
- Muitos suínos infectados não soroconvertem.
- Os anticorpos nem sempre são detectados durante todo o período de infecção.
- Alguma reatividade cruzada com outros Mycoplasmas, especialmente M. flocculare, que não é patogênico e é comumente encontrado em suínos.
Interpretação de resultados:
Patologia macroscópica:
- Positivo: A patologia macroscópica do pulmão pode fornecer um possível diagnóstico.
- Negativo: Os casos iniciais geralmente não apresentam lesões pulmonares extensas.
Cultivo bacteriano:
- Positivo: Confirma a doença.
- Negativo: Negativo, as bactérias não são detectadas se o teste for feito muito tempo após a infecção ou uso de antibióticos, ou simplesmente não podem crescer devido ao crescimento excessivo de outras bactérias (presentes, mas muito difíceis de crescer).
IHC:
- Positivo: As bactérias estão presentes no local da lesão.
- Negativo: Negativo ou infecção muito antiga para detectar a bactéria ou animal previamente tratado com antibióticos.
AF:
- Positivo: As bactérias estão presentes no local da lesão.
- Negativo: Negativo ou infecção muito antiga para detectar a bactéria ou animal previamente tratado com antibióticos.
PCR:
- Positivo: A bactéria está presente; não confirma a doença.
- Negativo: Negativo ou infecção muito antiga para detectar a bactéria ou animal previamente tratado com antibióticos.
ELISA:
- Positivo: Anticorpos maternos ou exposição anterior (geralmente 3 a 8 semanas após a exposição) à vacina ou bactérias do ambiente.
- Negativo: Negativo ou infecção que não estimula a soroconversão ou muito recente para ser detectada (geralmente leva de 3 a 8 semanas após a exposição).
Cenários
Suínos em crescimento com tosse crônica:
- Necropsia de 1 a 3 suínos recentemente mortos ou eutanasiados que tiveram com tosse. Avalia macroscopicamente os pulmões para consolidação cranioventral. Colete vários pedaços de pulmão (certifique-se de incluir as vias aéreas na amostra) e fixe-os em formalina para IHC ou AF.
- O percentual de pulmões com lesões está diretamente relacionado ao impacto econômico da doença.
Confirme se os animais de reposição são negativos para Mycoplasma hyopneumoniae
- Certifique-se de que não há sinais clínicos de tosse.
- Colete pelo menos 30 amostras de soro aleatórias de animais de reposição e analise-as por ELISA.
Monitore a excreção na reposição antes da introdução em uma granja de reprodutores positiva ou negativa
- Certifique-se de que não há sinais clínicos de tosse.
- Colete pelo menos 30 amostras de esfregaço laríngeo aleatórias dos animais de reposição. Misture-os em grupos de 5 ou 6 e analise por PCR.



