O nitrogênio total e amoniacal no dejeto é relativamente fácil de medir e, portanto, estimar o volume a ser aplicado em uma parcela com base nas necessidades da cultura e em conformidade com a Diretiva Nitratos. Pelo contrário, o nitrogênio, na forma de amônia (NH3) ou óxido nitroso (N2O) e metano (CH4) não são tão fáceis de medir, são como inimigos invisíveis diante de nossos olhos.
Inimigos porque são gases que os animais respiram e isso os afeta, se os dejetos forem armazenados em fossas sob ripas; pois com o nitrogênio volatilizado diminui o valor fertilizante e econômico do dejeto; porque com as emissões de CH4 reduz-se o potencial de produção de biogás para fins energéticos e econômicos; ou porque esses gases têm efeitos ambientais negativos, produzem chuva ácida no caso do NH3 e dos óxidos de nitrogênio e têm efeito estufa, cerca de 25 vezes mais que o CO2 para o CH4 e 298 vezes mais para o N2O. Evitar as emissões de NH3, N2O e CH4 deve fazer parte dos objetivos de melhorar o manejo dos dejetos da pecuária.

As reações mais importantes que ocorrem em uma lagoa de decomposição, ou no poço, que afetam as emissões são ilustradas na Figura.
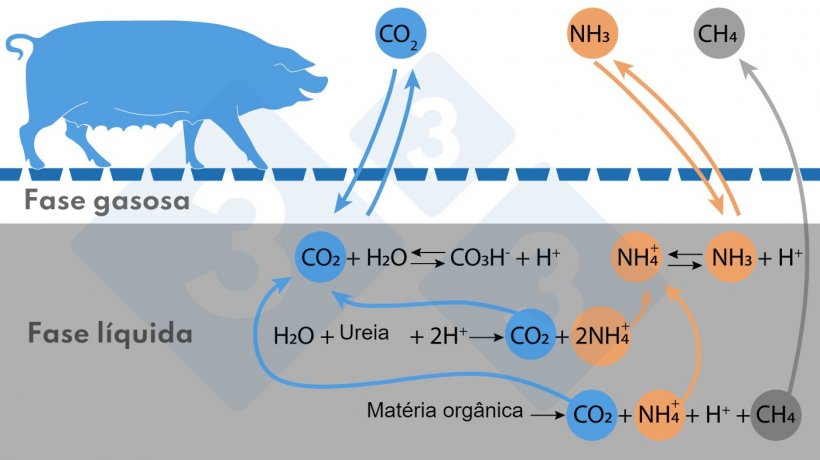
A principal fonte de nitrogênio amoniacal é a ureia, seguida pela decomposição anaeróbica da matéria orgânica contendo proteínas. O nitrogênio amoniacal é encontrado no meio líquido na forma ionizada (NH4+) e na forma de NH3. O balanço NH4+/NH3 depende do pH e da temperatura; à medida que a temperatura ou o pH aumenta, o equilíbrio se desloca para a direita (como indicado na Figura), formando mais NH3, que é volatilizável.
A origem do CH4 é a decomposição anaeróbica da matéria orgânica. Quanto mais sólidos voláteis (SV) digeríveis contidos na matéria orgânica, mais CH4 pode ser produzido.
Um terceiro gás que é emitido é o dióxido de carbono (CO2), que não é contabilizado como gás de efeito estufa por ser de origem biogênica. No meio líquido, este gás está em equilíbrio com o bicarbonato (CO3H-), o que permite regular o pH do meio. Quando os prótons (H+) envolvidos nas reações indicadas se acumulam, podem baixar o pH, mas neste caso o equilíbrio CO2/CO3H- se desloca para a esquerda e CO2 é emitido, ajudando a manter o pH próximo da neutralidade ou ligeiramente superior. Isso afeta negativamente o consumo de ácido se você deseja acidificar o composto para evitar a emissão de NH3.
As emissões diretas de N2O ocorrem como resultado de reações de oxidação de amônio a nitritos ou nitratos, ou redução destes a gás N2. Estas reações podem ocorrer de forma controlada em sistemas biológicos NDN (nitrificação - desnitrificação) ou de forma descontrolada em superfícies rugosas expostas à atmosfera. Do NH3 que se volatiliza, considera-se que 1% é oxidado a N2O na atmosfera (emissões indiretas).



