A resposta humoral específica começa quando um linfócito B naïve reconhece o seu antígeno específico nos tecidos e órgãos linfoides secundários (ver "Reconhecimento de agentes patogênicos").
Cada linfócito B tem um receptor de antígeno (BCR: Receptor de células B), uma imunoglobulina de superfície (IgM ou IgD), que se une a domínios específicos do antígeno chamados determinantes antigênicos ou epítopes.

A especificidade do sítio de união antigênica depende dos genes que codificam os domínios variáveis (VH e VL); nos mamíferos a recombinação e/ou conversão gênica podem gerar um grande número de genes e, em consequência, muitos BCRs distintos, capacitando o animal para reconhecer quase todos os antígenos externos.
Após o reconhecimento, cada linfócito B específico ativa-se, realiza uma proliferação clonal e diferencia-se num plasmócito (ou Célula Secretora de Anticorpos, ASC) capaz de sintetizar e secretar imunoglobulinas (anticorpos), específicas para o seu epítope.
As células T ajudam a otimizar a resposta humoral específica.
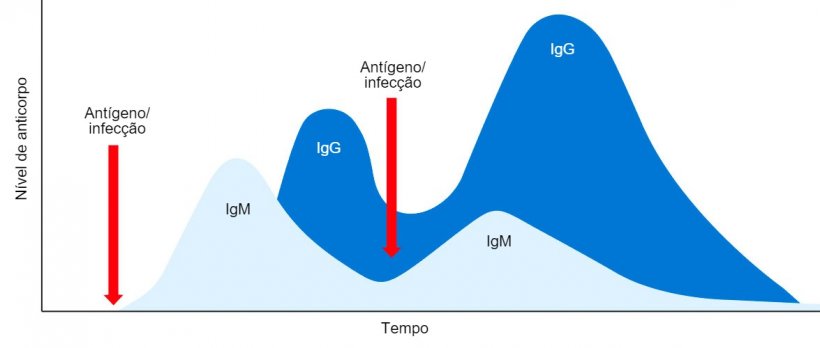
Inicialmente, as células B secretam IgM sob a forma monomérica e com uma especificidade antigênica idêntica.
Em relação ao tipo de secreção de anticorpos, os antígenos classificam-se como dependentes ou independentes das células T, consoante necessitem, ou não, da ajuda das células T para iniciar a resposta dos anticorpos.
Para certos antígenos, os chamados independentes das células T (por exemplo lipopolissacarídeos bacterianos, flagelina, polissacarídeos de pneumococos, etc.) só podem induzir anticorpos IgM com uma afinidade modesta e sem células B de memória.
Quase todos os antígenos externos são dependentes das células T e necessitam, para a ativação completa dos linfócitos B, um sinal adicional (citocina) procedente dos linfócitos T colaboradores específicos que reconheçam o mesmo antígeno (cooperação das células T e B).
Neste último caso, a célula B atua como uma célula apresentadora de antígenos, apresentando o antígeno processado às células T helpers que, quando é reconhecido, permite a mudança isotípica da Ig (comutação de classe de anticorpo) da IgM para imunoglobulinas de uma classe distinta, IgA, IgE ou IgG, dependendo da citocina secretada pela célula T helper, e envolvidas na estimulação da célula B (IL-4 ou IFNγ respectivamente). Outro sinal básico para a comutação do anticorpo é a interação do CD154 (CD40L) no receptor CD40 das células B.
Sob esta "ajuda", as células B proliferativas têm uma hipermutação somática da imunoglobulina de superfície, e passarão a estar dotadas de um isótipo específico. Estes linfócitos B são posteriormente selecionados com base numa afinidade ótima da Ig com o antígeno ao entrar em estreito contato com as células dendríticas foliculares que apresentam o antígeno. Só os linfócitos B com uma elevada afinidade do anticorpo para o antígeno e que são capazes de o processar e apresentar, serão selecionadas positivamente. Portanto, só estes últimos linfócitos B sobreviverão, proliferarão e diferenciar-se-ão em plasmócitos, sintetizando e secretando anticorpos de uma única classe isotípica, com uma especificidade única e afinidade elevada, melhorando a capacidade de aderir ao antígeno e, deste modo, neutralizar e destruir os agentes patogênicos.
Quando termina a resposta imune primária, algumas destas células B e plamócitos ativados e selecionados neste primeiro contato, sobreviverão como células de memória de vida longa, prontas para serem ativadas em futuras exposições ao mesmo antígeno (resposta imune secundária) produzindo a mesma classe de anticorpos com um maior título e afinidade.

Em conclusão, na resposta humoral primária, inicialmente é secretada uma única classe de IgM sob a forma monomérica e com idêntica especificidade antigénica. Uns dias depois, devido à comutação isotípica, são secretadas classes distintas de Ig, por exemplo, IgG. A resposta humoral secundária induzida por uma exposição posterior ao mesmo antígeno será caracterizada, principalmente, pela produção do isótipo de IgG mas com um título e afinidade mais elevadas (figura 1).
Os anticorpos podem atuar contra agentes patogênicos com diferentes mecanismos defensivos:
- Inibição da infectividade de agentes patogênicos unindo-se diretamente a eles (neutralização, bloqueio por adesão, exclusão imunitária).
- Ativação da via alternativa (opsonização) ou clássica do complemento com lise do agente patogênico.
- Ao cobrir o agente patogênico (ou células infectadas), os anticorpos permitem que as células acessórias, que reconhecem partes do fragmento cristalizável (Fc), ingiram e matem o agente patogênico por opsonização e fagocitose ou matem as células infectadas mediante ADCC ("Citotoxicidade Celular dependente de Anticorpos").
- Regulação da resposta imune através da interação com os receptores Fc (FcRs).
Os FcRs expressam-se em muitas células efetoras da imunidade inata, como os mastócitos, os neutrófilos, os monócitos, os macrófagos e as células dendríticas. Concretamente, quando os FcγRs (receptores Fc para IgG) se unem a complexos imunitários, desencadeiam a ativação das células inatas e a sua resposta efetora (fagocitose, explosão oxidativa, citotoxicidade, libertação de peptídeos vasoativos e quimioatraentes). Os FcRs das células dendríticas promovem a captura do antígeno, o seu processamento e a sua apresentação às células T citotóxicas e colaboradoras.
Pelo contrário, a FcR inibitória para a IgG, expressa nas células B, está implicada na regulação da ativação e desenvolvimento de células B e na sobrevivência de células plasmáticas.



